Trabajo de Incorporación como Individuo de Número de la Sociedad Venezolana de la Historia de la
Medicina
Correo fherreraivic@yahoo.com
Presentado julio 7, 2010
Recibido Febrero 3, 2011 Aceptado
El autor recorre el desarrollo de su interés en las ciencias naturales desde su infancia hasta su temprana adultez. Su curiosidad por seres microscópicos fue despertada por observaciones a través de un microscopio de juguete, regalo de su abuela paterna. Pasos titubeantes lo llevaron a explorar la vida microscópica: protozoos, algas, nemátodes, platelmintos y otros representantes de esa vida invisible a simple vista. Durante su bachillerato la curiosidad lo llevó a estudiar el Schistosoma mansoni y su ingenuidad, a recolectar caracoles que albergaban las fases extrahumanas de ese peligroso parásito .tropical y observar sus cercarías y larvas infectantes, al microscopio. Su madre, alarmada pidió ayuda a un experto del Ministerio de Sanidad, pero -contrariamente a sus expectativas- el experto lo puso en contacto con un investigador del parásito. Tiempo después, durante sus estudios de Medicina, el incipiente investigador se interesó en la histología del riñón y desarrolló un método para perfundir el fijador por vía intra-arterial, para preservar mejor la estructura tisular. Ese método logró excepcionales preparaciones que revelaron imágenes tan detalladas como las del microscopio de luz. Esa investigación condujo a su primer trabajo formal en una convención de la Asociación Venezolana para el Avance de la Ciencia, organización local de un país subdesarrollado. Como era de esperar, su trabajo permaneció desconocido para comunidades científicas avanzadas. El resultado fue que la fijación por perfusión intra-arterial del fijador fue redescubierta años después en laboratorios europeos y norte-americanos. Es el destino frecuente de estudios publicados en medios científicos poco reconocidos, en la periferia de la comunidad científica.
Palabras clave: biografía, investigación, schistosomiasis, histología renal
The author traces the development of his interest in science from early childhood to young adulthood, recalling how his curiosity about microscopic living beings was awakened by a toy microscope that was a gift from his grandmother. These first hesitant steps lead to the in depth observation of protozoa, algae, nematodes, flatworms and sundry other living specimens. Later, during his high school years, his curiosity was drawn to the study of the parasite Schistosoma mansoni. Being somewhat naïve, he collected snails harbouring the intermediate stages of this dangerous human parasite in order to observe these creature‟s infectious larvae, ceracariae, under the microscope. A very protective mother, being alarmed by this turn of events, attempted to dissuade him by insisting he consult an expert at the Ministry of Health. This expert, contrary to his mother‟s expectations, not only did not dissuade him but worst of all, encouraged him to start working with a specialist who was already investigating the same parasite. Some time later, during his medical studies, this fledgling investigator became interested in kidney histology, developing a method for intra-arterial perfusion of the kidneys with histological fixatives in an effort to better conserve tissue structure. The method yielded an exceptional preparation which enhanced the most detailed images of kidney tissue structure observable by light microscopy. This investigation led to the formal presentation of this concept by a fledgling scientific organization, in a backward country. Then, as was to be expected, this work remained unknown in the more mature scientific communities resulting in the intra-arterial fixative perfusion having to be rediscovered in European and North American laboratories some years later. This is very often the case when studies are published in little known scientific media within the confines of countries on the periphery of scientific activity.
Key words: biography, research, schistosomiasis, histology, kidney
Los posibles móviles de la inclinación del hombre hacia la investigación científica los expusimos hace varios años en nuestro discurso de incorporación como Individuo de Número de la Academia Nacional de Medicina: “Hace años, al comienzo de mi carrera, un investigador ya establecido me expresó que la gente realizaba investigación por cuatro razones fundamentales: obtener renombre, obtener poder, afán de lucro y posiblemente resolver algunos problemas de la humanidad. Le contesté que se le había escapado la razón principal: la curiosidad, tratar de entender el mundo. Demás está decir que no estuvo de acuerdo conmigo. Yo creo que el investigador es un niño que creció sin perder su curiosidad innata”.
Recodamos haber sido siempre impelidos por la curiosidad de observar y comprender el funcionamiento de los seres vivos. Uno de los primeros juguetes que tuvimos fue un microscopito que nos regaló nuestra abuela paterna (Fig 1)

Con ese pequeño microscopio conocimos el Paramecio, la Vorticella, el Euplotes, el Spirostomum entre los protozoos, platelmintos y nemátodos entre los metazoos, Spirogyra, y Nostoc entre las algas, y muchos otros seres vivos microscópicos. El libro de Gastón Tissandier, “Las recreaciones científicas o la enseñanza por los juegos” (1) y la “Galería de Historia Natural” del Conde de Bufón (2) fueron las dos primeras obras divulgativas que recordamos haber leído. Posteriormente, en 1946, compramos un microscopio mejor y al final del nuestro segundo año de bachillerato, nuestro padre nos regaló un microscopio Bausch and Lomb binocular, por todo lo alto (Fig 2)
Producto de nuestras lecturas del libro de parasitología de Asa C. Chandler (3) ya estábamos informados sobre los ciclos vitales de muchos parásitos. El parásito que más nos interesó en el momento fue el Schistosoma mansoni, o bilharzia. La bilharziasis estaba muy extendida en los estados centrales del país (Aragua, Miranda, Carabobo y Distrito Federal) y en la familia nos aterrorizaban con la posibilidad de contraer la enfermedad. Nos estaba terminantemente prohibido siquiera mojarnos las manos con el agua de las muchas quebradas que existían por ese tiempo en los alrededores de Caracas (Fig 3)

Con el fin de conocer el Schistosoma mansoni, adquirimos 20 tubos de ensayo de 25 mm de diámetro y unos 200 mm de largo y salimos a capturar los hospedadores intermedios del parásito, el caracol de agua dulce Biomphalaria glabrata, denominado en esa época Planorbis guadelupensis. Nos dirigimos a la hacienda La Ciénaga propiedad de la familia Díaz descendientes del Dr. Manuel Díaz Rodríguez, médico y escritor. Hoy en día esta hacienda forma parte del Parque del Este. En una de las acequias de la hacienda capturamos los caracoles.
Nuestras lecturas parasitológicas: Chandler (3), Faust (4), Mayer y Pifano (5) Brumpt (6), nos habían informado que las cercarias emergían del caracol entre las 10 y 12 del día, al ser éstos expuestos a la luz del sol. Así pues, introdujimos un caracol en cada tubo, con suficiente agua de lluvia; los expusimos a la luz solar a las 10 de la mañana y cual no sería nuestra alegría cuando vimos emerger de 14 caracoles una gran cantidad de pequeñísimos y finísimos hilos que subían y bajaban en posición vertical dentro de los tubos. Eran cercarias mansoni.
Nuestra madre se enteró de los experimentos que estábamos realizando y alarmada llamó al Dr. José Antonio Jove, Ingeniero Jefe de la División de Ingeniería Sanitaria, Dirección de Salud Pública, Ministerio de Sanidad y Asistencia Social (MSAS) para que nos advirtiera de los peligros a que nos exponíamos y nos disuadiera de seguir por ese camino. Muy al contrario de lo que esperaba nuestra madre, el Dr. Jove no nos disuadió, sino que nos sugirió que nos pusiéramos en contacto con el Dr. Eugeniusz Gerulewicz del Laboratorio de Bilharzia de la División. (Fig. 4). El laboratorio se encontraba debajo del Puente Sucre, en San Agustín del Sur. Disfrutamos de las enseñanzas del Dr. Gerulewicz por dos años, hasta que el laboratorio fue eliminado o tal vez transferido a Vivienda Rural, cuando comenzó la construcción de la Avenida Fuerzas Armadas.

Desarrollamos una coloración tricrómica para las cercarias, muy bella, empleando el borax carmín, que coloreaba de rojo las glándulas de penetración de la larva, hematoxilina para los núcleos y fast green como coloración de fondo (Figs. 5 y 6) Estas láminas tienen más de 60 años y todavía conservan su coloración original. Llevaba dicho material al MSAS y nos pagaban Bs. 300, por no recordamos cuantas.
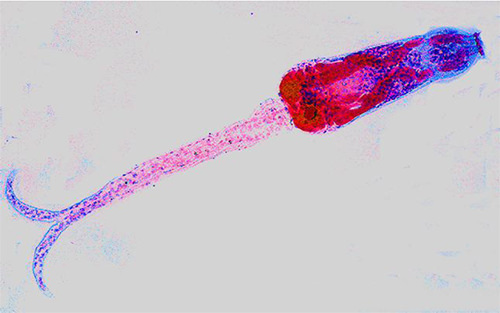
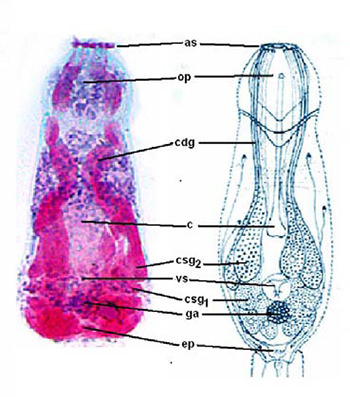
Las fotografías que se muestran en este trabajo fueron tomadas con instrumentos más modernos: un microscopio Zeiss Axioskop 20 y una cámara digital AGFA DC-1033m. (Fig 7)

Aquí ocurre nuestra primera desventura en la iniciación a la investigación: no anotamos el procedimiento para la coloración. Sí recordamos que los cambios de soluciones los llevaba a cabo centrifugando las cercarias entre cada paso. Ya para esta época éramos felices poseedores de una centrífuga eléctrica que adquirimos en la casa Vargas donde también comprábamos los colorantes y reactivos para preparar fijadores, deshidratar, aclarar y montar las cercarias en bálsamo del Canadá.
Con los emolumentos del Ministerio ya habíamos reunido la ingente suma de mil bolívares. En la casa Sánitas, de la familia Zschaeck, que vendía equipos médicos, adquirimos un micrótomo Reichert tipo Minot que valía la fabulosa suma de Bs. 949,60.
Provisto ya de un micrótomo, pudimos emplear la técnica de inclusión en parafina y así seccionar tejidos. Los primeros cortes que preparamos fueron del hepatopancreas y órgano hermafrodita del planorbis donde se desarrollaba el ciclo intermedio de la bilharzia.
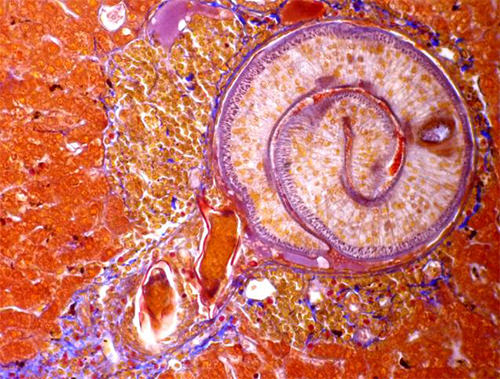
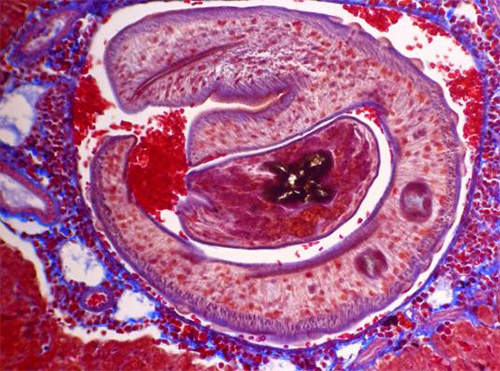
Muy posteriormente, por cortesía de la Dra. Hilda Pérez del laboratorio de Inmunoparasitología del IVIC recibimos hígados de roedores infectados con Schistosoma mansoni. Este material fue cortado y coloreado con Azan de Heidenhain en nuestro laboratorio. Pudimos observar un granuloma bilharziano que englobaba un verme macho adulto acompañado de dos huevos degradados. (Fig 8)
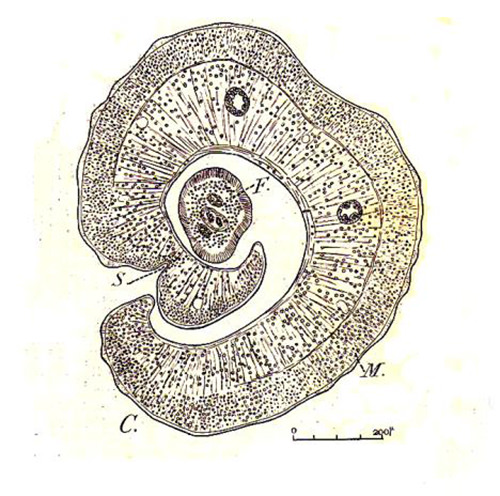
Asimismo pudimos encontrar dentro de un granuloma bilharziano, un verme macho envolviendo a una hembra en su canal ginecóforo. La preparación histológica es casi identica a una lámina de Brumpt (6) en su Précis de Parasitologie, como se observa en la Fig 9.
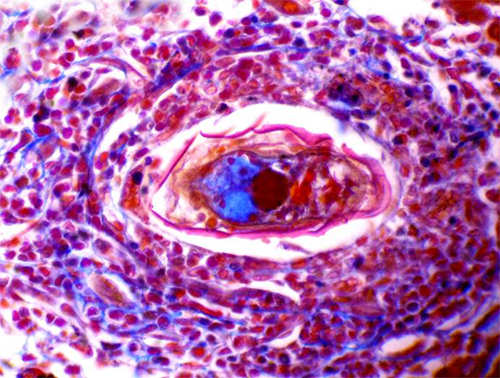
También pudimos observar un granuloma bilharziano que rodeaba un huevo de schistosoma con un miracidio bastante bien conservado en su interior. (Fig 10)
Es hora de ir dejando atrás al Schistosoma mansoni y abocarnos al tema principal: la fijación el riñón de rata por perfusión intrarterial
Cuando comenzamos el Primer Año de Medicina entramos en contacto con el Dr. Alberto Rivero, Profesor de Histología y Embriología y amigo de nuestra familia. Al poco tiempo ya estábamos aposentados en el laboratorio donde se realizaban las preparaciones histológicas para las prácticas de histología. El Dr. Rivero nos puso a prueba varias veces. Nos proponía realizar coloraciones que él encontraba en la literatura, nos encomendó hacer cortes seriados de un embrión de cochino de 10 mm, un total de mil cortes que hubimos de preservar y colorear muy cuidadosamente con Azan de Heidenhain y montar en unas cien láminas. Probablemente salimos airosos de estas pruebas porque un día nos dijo
- “Eres un gran técnico” Un gran elogio, viniendo del Dr. Rivero.
Cuando íbamos por el cuarto año de medicina se nos ocurrió, como a muchos que han hecho estudios histológicos, que una de las causas principales de artefactos en las preparaciones histológicas es la deficiente fijación o preservación del tejido debido a la lenta difusión del fijador en el tejido. Pensamos que si se canulábamos la arteria principal de un órgano, se perfundía con una solución fisiológica, previa sección de la vena cava para permitir la salida de la solución y una vez exsangüe el órgano, se perfundía con el fijador, la conservación del tejido sería mucho mejor porque el fijador llegaría casi instantáneamente al parénquim
Para realizar la perfusión procedimos a irrigar el árbol vascular de la rata con una solución lavadora (Prolidón, expansor del plasma fabricado por Laboratorios Behrens) Al Prolidón se le añadía nitrito de sodio como vasodilatador. Este mismo método, inclusive el uso de nitrito de sodio como vasodilatador, fue propuesto, muy posterior-mente por Palay y col. (7) en 1962 y por Maunsbach en 1966 (8) La solución lavadora estaba contenida en un segmento de tubo de vidrio de una capacidad de alrededor de 100 mililitros. El extremo inferior del tubo estaba obturado por un tapón de goma monohoradado a través de cuya perforación se introducía un segmento de tubo de vidrio que se conectaba a una rama de un tubo en Y mediante un tubo de goma de irrigadora vaginal, de las que vendían en las farmacias en esa época. El tubo de goma se obturaba mediante la pinza que traía la irrigadora. A la otra rama del tubo en Y se conectaba del mismo modo a un segmento de tubo de vidrio de igual capacidad que el primero lleno de fijador de Zenker. La tercera rama del tubo en Y se insertaba en un tubo de goma que terminaba en una cánula de vidrio del diámetro aproximado de la arteria aorta de la rata, el animal de experimentación.
Era necesario darle una presión cercana a la arterial a las soluciones en cada uno de los tubos de vidrio. A este fin los tubos estaban provistos en su extremo superior de tapones de goma monohoradados por donde se introducía un tubo de vidrio. Cada tubo de vidrio se conectaba, mediante tubos de goma, a una rama de un tubo en Y. La tercera rama se conectaba a una primitiva botella de Mariotte llena de agua hasta un nivel de un metro por encima del de la aorta del animal. Los depósitos que contenían la solución lavadora y el fijador se sumergían en una lata de las que se expendía la manteca de cochino cuya capacidad de era de16 litros y contenía agua a 38º C.
Para iniciar la perfusión se canulaba la aorta torácica y se fijaba la cánula a la arteria mediante una ligadura. A continuación, se abría la pinza que obstruía el tubo de goma que salía del depósito de solución fisiológica y se seccionaba la vena cava inferior para drenar la solución. Al quedar exsangüe los riñones, se cerraba la pinza de la solución lavadora y se abría la del fijador y se dejaba correr hasta que había fluido todo el fijador del segundo tubo. Después se sumergían los riñones en fijador durante varias horas para proceder con la técnica de inclusión y corte en parafina. Nuestro primitivo e inelegante dispositivo para la fijación por irrigación arterial exasperó al Dr. Rivero quien un día nos dijo, poco después de caer Pérez Jiménez:
-En el cerro de Pipe han abierto un instituto donde puedes llevar tus latas de manteca y tubos de irrigadora. Hablé con el Dr. Luís Manuel Carbonell para que te reciba allá.
Así se inició una larga y fructífera amistad entre el Dr. Carbonell y el autor de estas líneas. Procedimos a montar de nuevo la trampajaula en el Instituto Venezolano de Investigaciones Científicas (IVIC), donde los tubos de goma de irrigadora se sustituyeron por elegantes tubos de látex y las pinzas obturadoras por igualmente elegantes llaves de paso de vidrio, y continuamos con el estudio histológico del riñón e iniciamos, bajo la tutela del Dr. Carbonell, el estudio de la histoquímica, disciplina que comenzó a florecer en esos años.
De los riñones fijados por perfusión se cortaron secciones de 5 micras en el micrótomo y se colorearon mediante el procedimiento Azan de Heidenhain (9) Los colorantes empleados en este método son azocarmín G, orange G y azul de anilina. Este trabajo dio origen a nuestra primera comunicación científica que se presentó en la IX Convención Anual de la Asociación Venezolana para el Avance de la Ciencia en junio de 1959 (10) Quisiéramos, en este momento, rememorar dicha sesión. La presidía el Dr. Marcel Roche y como era costumbre en esa época, el público y los expositores formaban un grupo exiguo. El Dr. Roche sugirió que realizáramos la sesión en el Restaurant Tarzilandia. Nos llevamos un proyector y una pantalla pequeña y así fue como expusimos nuestros trabajos entre suculentos beefsteaks que generosamente subvencionó el Dr. Roche. Qué diferencia entre esa ciencia ingenua y el horror que se vive hoy cuando de hacer investigación se trata.
Recientemente hemos revisado de nuevo los pocos cortes coloreados de este trabajo que aún conservamos. Estos cortes se prepararon hace 51 años y la coloración se mantiene perfectamente. Citamos a continuación parte del resumen del trabajo:
“Se observó una buena fijación de los ribetes en cepillo de los túbulos contorneados proximales y la conservación de una estructura de apariencia fibrilar, análoga a los ribetes en cepillo de los túbulos contorneados proximales, en los túbulos contorneados distales (sic) de riñones preparados por este método. Dicha estructura está mal conservada en riñones fijados por inmersión.”
De acuerdo con la literatura moderna, todos los túbulos con ribete en cepillo son proximales. Este ribete posiblemente representa una disposición de la membrana luminal de las células para aumentar su superficie ya que en los túbulos proximales se reabsorbe el 70% del ultrafiltrado plasmático generado a nivel del glomérulo. El túbulo proximal se considera constituido por tres segmentos (S1, S2, S3) con diferente morfología.
La diferencia en morfología que se observa en los túbulos proximales en las secciones de riñón, se debe a que pertenecen a segmentos distintos del tubo proximal (11, 12). Tisher y colaboradores (13) también consideran el túbulo proximal del mono Rhesus como constituido por tres segmentos. En el presente trabajo aprovecharemos las descripciones de Maunsbach y Tischer para denotar las secciones del túbulo proximal. A continuación presentaremos las figuras donde se reproducen las estructuras reveladas en estas preparaciones.
Comenzaremos por la primera porción del túbulo proximal (Fig 11)
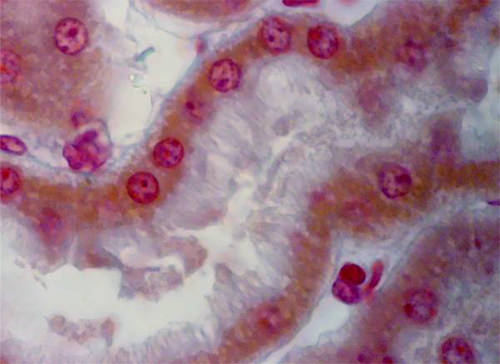
Era necesario identificar con seguridad esta primera porción del túbulo, lo cual sólo podría hacerse demostrando la continuidad de la primera porción con la cápsula de Bowman (Fig 12)
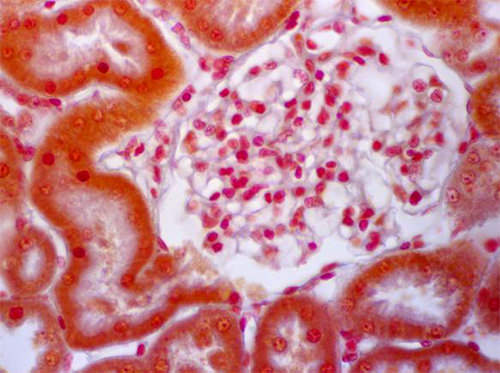
A continuación presentamos el segmento 2 del túbulo proximal. (Fig 13)
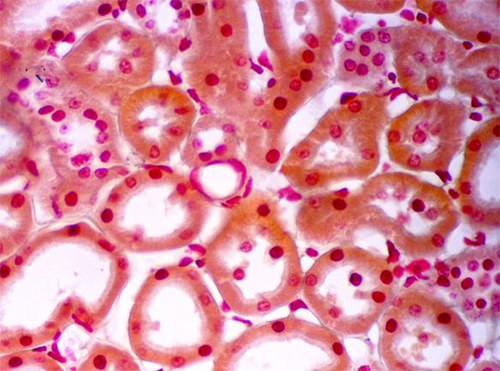
Finalmente, exhibiremos el segmento 3 del túbulo proximal. (Fig 14)
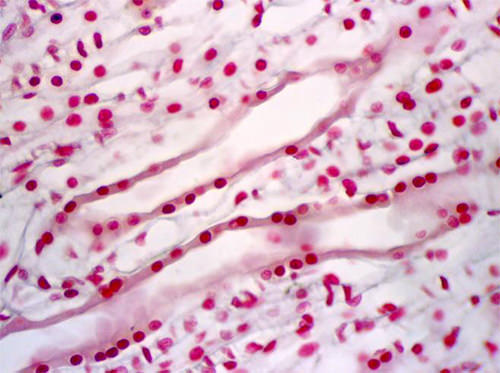
El segmento 3 del túbulo proximal se continúa con la porción delgada del asa de Henle como demuestra la próxima figura. (Fig 15)
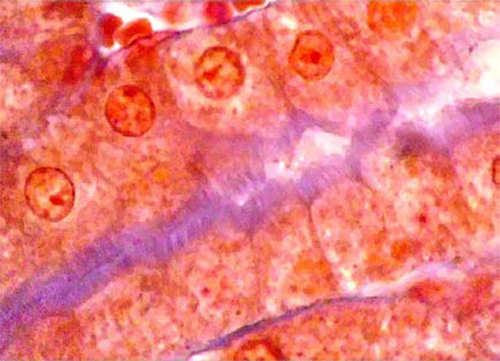
A continuación observamos cortes longitudinales de las porciones delgadas, a la izquierda y gruesas a la derecha, del asa de Henle. No se observa ribete en cepillo.
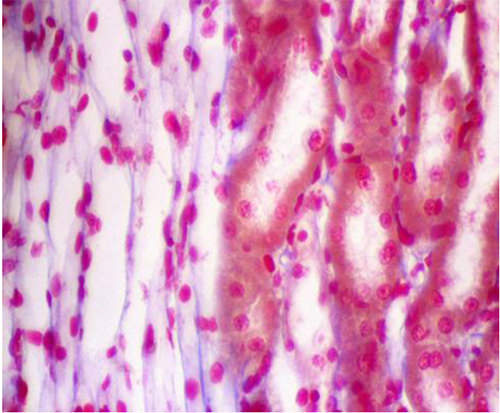
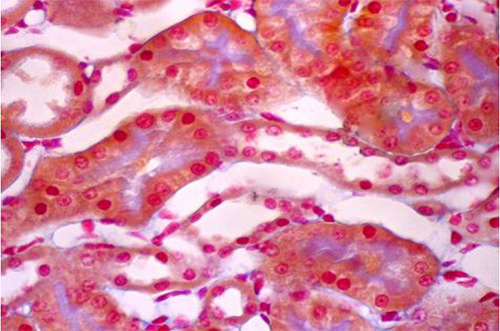
La Fig 17 muestra un corte longitudinal de un túbulo distal que discurre diagonalmente desde la esquina inferior izquierda hasta la esquina superior derecha de la figura. A ambos lados del túbulo se observan dos cortes transversales de segmentos 3 de túbulos proximales, uno en la esquina superior izquierda y otro en la esquina inferior derecha.
En la Figura 18 observamos cortes transversos de túbulos contorneados distales que se reconocen por la ausencia de ribete en cepillo y citoplasma relativamente homogéneo.
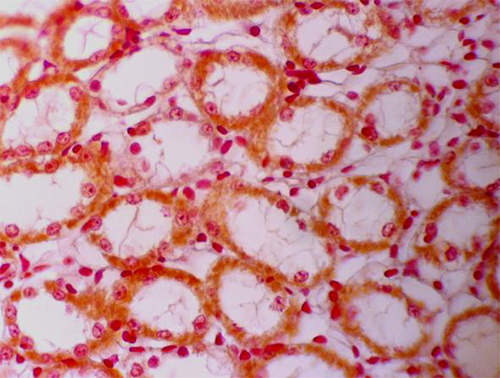
Los túbulos contorneados dístales desembocan en los túbulos colectores que se muestran en la Fig 19.
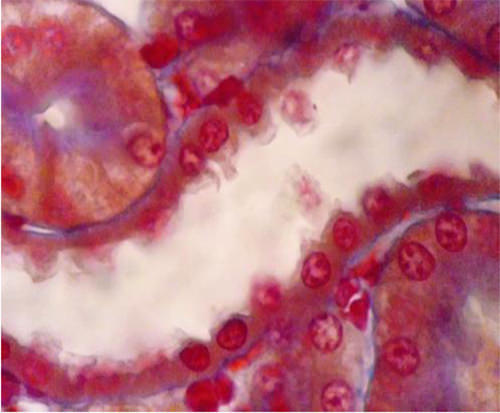
Otra estructura que se muestra muy claramente en estas preparaciones es el aparato yuxtaglomerular, Fig 20.
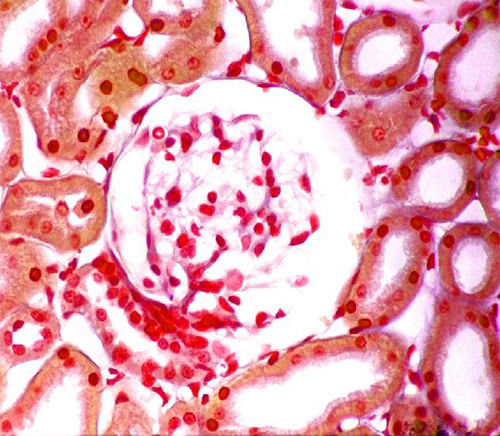
En estas preparaciones, el ribete en cepillo está muy bien conservado, a diferencia de preparaciones para microscopía de luz fijadas por inmersión, en las que los ribetes están mal conservados o inexistentes. El Dr. López Loyo nos ha hecho la observación de que la degeneración inicial del epitelio de los túbulos, que se describe en la actualidad en términos de degeneración hidrópica, estaría entre los primeros cambios degenerativos observados y resultaría de la interrupción de la circulación y la consecuente anoxia. Esta última conduciría a la acumulación de cloruro de sodio y agua dentro de la célula epitelial causada por la interrupción de la expulsión del sodio (acompañado por cloruro y agua) al detenerse la actividad de la bomba sodio y potasio (14)
En la mayoría de las figuras de este trabajo se observa que la luz de los túbulos está distendida o abierta lo cual indica muy buena conservación ya que se ha observado que los túbulos se colapsaban en menos de 20 segundos a partir de la interrupción del flujo sanguíneo (15, 16) Sería interesante comparar la descripción que hicimos en 1959 de estos túbulos con observaciones modernas. Hanssen y Maunsbach (15,16). aplicaron el método de perfusión intravascular al riñón de ratón y rata con el fin de preservarlo con fijadores apropiados para la microscopía electrónica. Estos trabajos son un claro ejemplo de cómo en la investigación una idea puede surgir en varios cerebros casi al mismo tiempo. Un número de investigadores lleva a cabo la investigación por caminos similares. Esta situación tiene la ventaja de que se confirman los trabajos casi simultáneamente. No obstante, en muchos casos conduce a agrias disputas sobre prioridad.
Como se desprende de lo anterior, el método de fijación por perfusión intrarterial ha sido empleado en diversas ocasiones posteriormente a nuestra primera descripción, la cual no fue citada posiblemente por haber sido comunicada en la convención científica nacional, en un país de baja proyección científica y no haber tenido ninguna difusión. Aquí tenemos clara prueba de que ningún trabajo inicial es absolutamente indispensable ya que otros similares o iguales se desarrollarían de manera paralela o posterior e independiente ya que la idea estaba “en el aire”. Nuestro modesto trabajo original permaneció desconocido, por su oscuro origen en una región periférica de la ciencia, mientras otros investigadores, mejor situados y conectados harían conocer sus trabajos más ampliamente, a pesar de que eran muy posteriores a los nuestros. Aunque, los trabajos realizados por estos últimos investigadores fueron mucho más profundos y extensos que el nuestro, el nuestro fue el predecesor.-