La enfermedad de Chagas es una enfermedad tropical, producto de la infección por el Tripanosoma cruzi. La enfermedad fue descrita originalmente en 1909 por Carlo Chagas, un médico brasilero mientras trabajaba en el Instituto Oswaldo Cruz en Río de Janeiro. Numerosas referencias históricas indican que la enfermedad de Chagas estaba presente en Latinoamérica desde los inicios del Siglo XVI, afectando tanto a los habitantes indígenas como a los conquistadores. En la actualidad se estima que 6,6 millones de personas, la mayoría en México, América central y América del Sur sufren la enfermedad, resultando en aproximadamente unas 8.000 muertes por año. La mayoría pertenece a las clases sociales pobres quienes no saben que están infectados. La enfermedad de Chagas está considerada como una enfermedad tropical olvidada. El primer caso en Venezuela fue descrito por Enrique Tejera en 1919.
Palabras clave: Enfermedad de Chagas, T. cruzi, tripanosomiasis, Carlo Chagas, Enrique Tejera
Chagas disease is a tropical disease, caused by an infection with the parasite Trypanosoma cruzi. The disease was originally described in 1909 by Carlo Chagas, a Brazilian physician while working at the Oswaldo Cruz Institute in Rio de Janeiro. Numerous historical references indicate that Chagas disease was present in Latin America since the beginning of the 16th century, affecting both the indigenous inhabitants and the conquerors. Currently an estimated 6.6 million people, the majority in Mexico, Central America, and South America suffer from the disease, resulting in approximately 8,000 deaths per year. The majority belong to the poor social classes who do not know that they are infected. Chagas disease is classified as a neglected tropical disease. The first case in Venezuela was described by Enrique Tejera in 1919.
Keys words Chagas disease, T. cruzi, trypanosomiasis, Carlo Chagas, Enrique Tejera
(Trabajo presentado en el XI Congreso de la Sociedad Venezolana de Historia de la Medicina realizado en Caracas, del 22 al 24 de octubre de 2019)
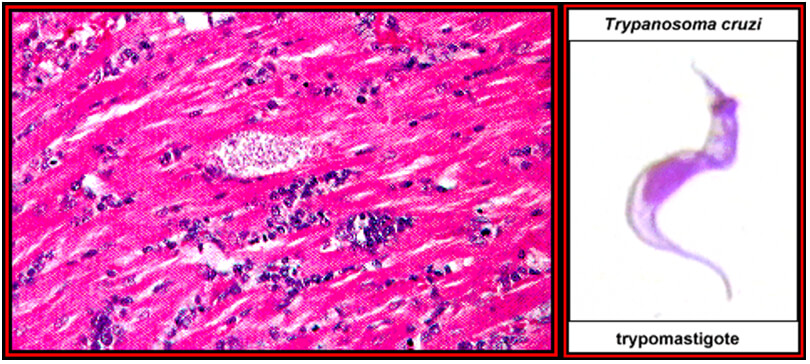
La enfermedad de Chagas (ECh) es el producto de la infección por Tripanosoma cruzi descrita por Carlo Chagas (Fig. 1), un médico brasilero mientras trabajaba en el Instituto Oswaldo Cruz en Río de Janeiro [1]. El Dr. Chagas describió las formas del parasito T. cruzi como epimastigotes en el intestino anterior y tripomastigotes metacíclicos en el intestino posterior de un insecto, el Panstrongylus megistus capturado en una vivienda rural humana en el campo, en el Estado de Minas Gerais, Brasil, en 1909. Posteriormente encontró tripomastigotes en la sangre de un gato doméstico y durante la investigación de una fiebre persistente de origen desconocido en un niño de 1 año de edad encontró por serendipia tripomastigotes de T. cruzi en la sangre periférica en una lámina de extendido de sangre coloreada al microscopio de luz [2].

La tripanosomiasis americana es una enfermedad tropical, causada por T. cruzi [3] , [4]. Los síntomas cambian durante el curso de la infección, al inicio son moderados o ausentes, caracterizados por fiebre, malestar general, edema de los ganglios linfáticos, cefaleas, y edema local en la piel en el sitio de la picada del insecto [3,4]. Posteriormente a las 8-12 semanas la persona entra en la fase crónica de la enfermedad no apareciendo más síntomas en el 60-70% de los infectados [5, 6] mientras en el 30-40% restante se desarrollan síntomas 10-30 años después de la infección inicial [5] incluyendo un 20–30%, aumento de los ventrículos cardiacos que conduce a la insuficiencia cardiaca [4], megaesofago y megacolon en 10% de los pacientes [4].



T. cruzi se disemina en la especie humana y otros mamíferos mediante insectos hematófagos llamados “insectos del beso” de la subfamilia Triatominae [6,7] que se conocen por distintos nombres en varios países: Vinchuca en Argentina, Bolivia y Chile; Paragua o Barbeiro en Brasil; Pito en Colombia; Chinche en América Central y Chipo en Venezuela [8]. La enfermedad también se transmite por transfusión sanguina, trasplantes de órganos, comer alimentos contaminados por parásitos, o por transmisión vertical a través de la placenta de la madre al feto [4].
El diagnóstico de la enfermedad en su fase inicial se realiza al encontrar el parásito en la sangre mediante el microscopio de luz [5]. La enfermad crónica se diagnostica mediante el hallazgo de anticuerpos contra T. cruzi en la sangre [5] o mediante el xenodiagnostico. La prevalencia general de enfermedad de Chagas en 3.000 puérperas estudiadas fue de 0,73%; mayor en dos centros de salud ubicados en zonas rurales (2,2% en El Pedregal y 4,1% en La Joya) (P = 0,018) y la enfermedad estuvo asociada con el contacto directo previo con el vector (P < 0,05) y con el haber nacido en una zona considerada endémica (P < 0,01). Cuatro de las 20 puérperas con seropositividad (20%) tuvieron resultados positivos en el xenodiagnóstico. Ninguna conocía su estado de portadora de la infección y no se observaron síntomas o signos característicos de la enfermedad de Chagas aguda o crónica. En ninguna puérpera se detectaron anticuerpos IgM y solo un neonato, nacido de una madre sin parasitemia, presentó un título de IgM de 1/8, pero en los controles posteriores no se detectaron anticuerpos IgM o IgG. No se detectaron parásitos en la sangre de los neonatos por ninguno de los dos métodos empleados. De los 20 neonatos evaluados, uno tenía microcefalia y hepatoesplenomegalia y aunque tenía anticuerpos específicos IgG contra T. cruzi al nacer, estos desaparecieron a los dos meses; el crecimiento y el desarrollo de los demás recién nacidos fueron normales [9].
La prevención de la ECh se basa en el uso de insecticidas y mosquiteros para prevenir la picada de los Triatomineos [4,10], así como el despistaje del parásito en las trasfusiones sanguíneas [4] pues una vacuna con eficacia protectora no ha sido desarrollada [4]. Las infecciones tempranas se han tratado con Benznidazole o Nifurtimox [4]. Estos medicamentos producen la cura de la enfermedad si se dan al comienzo de la misma, pero son menos efectivos a medida que la persona entra en la enfermedad de Chagas crónica, donde pueden retardar el desarrollo de los síntomas finales de la enfermedad aunque no tienen efecto sobre los amastigotes productores de las lesiones cardiacas [4]. El Benznidazole y el Nifurtimox, causan efectos secundarios temporales en el 40% de los pacientes [4] incluyendo lesiones en la piel, toxicidad cerebral e irritación del sistema digestivo [6] , [11].
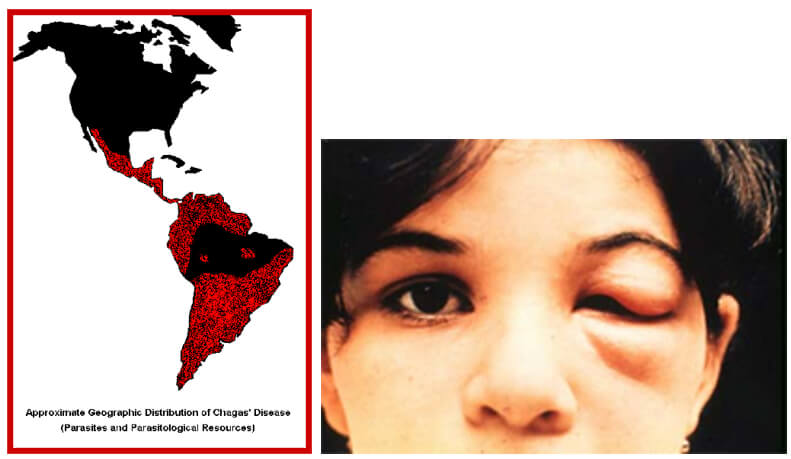
Se estima que 6,6 millones de personas, la mayoría en México, América central y América del Sur tienen ECh según los datos del año 2015 [4,12,13] resultando en aproximadamente unas 8.000 muertes por año [14]. La mayoría pertenece a las clases sociales pobres [6] quienes no saben que están infectados [15]. Las migraciones de gran escala han aumentado las áreas geográficas donde se encuentra la ECh, incluyendo países Europeos y los Estados Unidos [4] que han visto un incremento de casos hasta el año 2014 [16] donde existen estadísticas poblacionales. La ECh está clasificada como una enfermedad tropical olvidada [17], afecta a más de 150 especies de animales en la jungla [6] así como también animales domésticos [18], y es transmitida por varios vectores ya mencionados [19].
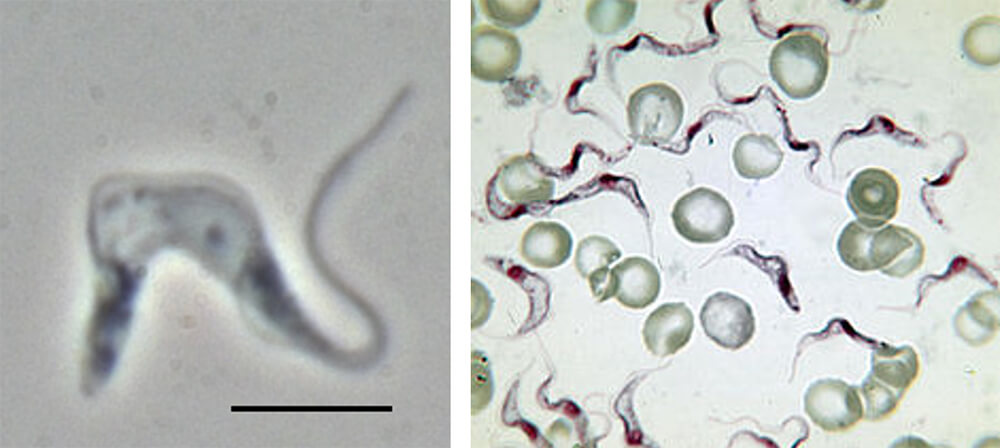
El T. brucei es un parásito que se encuentra en la sangre y puede invadir otros tejidos, incluyendo el sistema nervioso. Causa la tripanosomiasis africana o enfermedad del sueño en humanos y animales (nagana) en África. Hay tres subespecies de este parásito: 1. T. brucei gambiense, que causa la tripanosomiasis crónica de inicio lento; 2. T. brucei. rhodesiense, que causa la tripanosomiasis aguda de inicio rápido; 3. T. brucei. brucei, que causa la tripanosomiasis animal africana o nagana, al igual que otras especies de tripanosomas. Estas especies de tripanosomas parasitan dos huéspedes, un vector insecto, la mosca tse-tsé y un huésped mamífero. Debido a la gran diferencia entre estos dos huéspedes, el parasito experimenta cambios complejos para facilitar su supervivencia en el intestino de los insectos y en la sangre de los mamíferos. Asimismo, cuenta con una única y notable cubierta de glicoproteína variante de superficie (VSG) en su membrana plasmática, con el fin de evitar al sistema inmunitario del huésped. Esta capa tiene dos funciones:
1. Una barrera física que bloquea el reconocimiento de la célula por el sistema inmune específico del mamífero huésped y oculta las proteínas invariantes de la superficie tales como los canales iónicos, los receptores, al reconocimiento del sistema inmunitario; 2- Una superficie variable para la célula, lo que permite la variación y adaptación específica para evitar al sistema inmunitario. Se cree que esta capa, altamente variable, es codificada por varios cientos de copias alternativas de un gen en el genoma. En cada célula, y en toda una población de células en el huésped, se expresa la misma capa de proteínas, pero esta expresión es inestable y es probable que cambie con la próxima generación de parásitos. Se han apreciado tasas de conmutación de hasta 1 por cada 50 células en una generación. La proteína se compone de un dominio N terminal muy variable de alrededor de 300 a 350 aminoácidos, y un dominio C terminal más conservativo de unos 100 aminoácidos. El dominio C terminal forma un paquete estructural de 4 hélices alfa, mientras que el dominio N terminal forma un 'halo' alrededor de las hélices. La estructura terciaria de este halo es bastante constante lo cual es sorprendente, dado que las secuencias de aminoácidos varían mucho, lo que permite el empaquetamiento próximo que se requiere para la formación de la barrera física VSG, la cual se ancla a la membrana celular por medio de un ancla GPI, un enlace covalente del terminal C, a través de 4 azúcares, al ácido fosfatidilcolina-inositol fosfolípido de la membrana celular. El genoma contiene múltiples copias del gen que codifica las VSG. Alrededor de 20 copias se encuentran en los cromosomas largos e intermedios que están activos y potencialmente transcritos, aunque sea sólo uno por célula. Alrededor de 100 copias se encuentran cerca de los telómeros de los mini-cromosomas. Estos no están activos, pero se activan a través de una recombinación que se traslada a un lugar de transcripción activa, que producirá una proteína VSG funcional. Por último, alrededor de 1000 copias se encuentran en secciones repetidas en el interior de los cromosomas. Estos están generalmente inactivos, debido a secciones omitidas o codones de parada prematura, pero son importantes en la evolución de nuevos genes VSG. Se calcula que hasta un 10% del genoma T. brucei podría estar compuesto por genes o pseudogenes VSG. Tras la infección, el tripanosoma expresa una VSG en particular. Como el sistema inmunitario del huésped genera una respuesta concreta a esta capa de proteínas, se producirá una disminución de la población de tripanosomas. En este punto, una célula que exprese una VSG alternativa será fuertemente seleccionada y repoblará la infección. El efecto general de este ciclo de proliferación y decaimiento de la población debido al ciclo de la relación predador/presa con el sistema inmunitario del huésped da lugar a una sucesión de episodios de infección, cada uno debido a una población con diferentes expresiones de cubiertas VSG. Mucha de la investigación sobre Trypanosoma brucei se realiza primero sobre Crithidia fasciculata, un organismo similar pero que no es peligroso para los seres humanos. El Tripanosoma brucei fue identificado por primera vez en 1895, por el patólogo David Bruce, como agente de la nagana y de la enfermedad del sueño. T. b. gambiense se describió primero, en 1902 por Joseph Everett Dutton. Ya en 1910, Stephens y Fantham, describieron T. b. rhodesiense [20].
Al analizar filogenéticamente el rRNA 18S se encontró que los tripanosomas salivales transmitidos por picaduras de la mosca Tse-tsé del grupo T. brucei se separaron de los tripanosomas estercolarios como el T. cruzi trasmitidos por contaminación fecal de los Triatomineos, aproximadamente hace 100 millones de años [21]. Al mismo tiempo de la separación de Sur América, Antártica y Australia del África, se pensó que T. cruzi y los tripanosomas relacionados habían evolucionado en aislamiento en mamíferos terrestres primitivos [22], idea conocida como la hipótesis del Súper-Continente del sur. Basados en este escenario se esperaría una gran diversidad en el grupo de tripanosomas en los mamíferos terrestres Sur-Americanos, pues han estado presentes en esa área geográfica desde la separación del Súper-Continente hace 40 millones de años [22], lo cual no ha sucedido y ninguna especie nueva de buena fe ha sido descubierta en el grupo de T cruzi en ningún mamífero terrestre Sur-Americano hasta el día de hoy [22], por lo tanto no ha habido co-evolución generando genotipos específicos de especie en los huéspedes mamíferos. Además grupos de T cruzi también están presentes en mamíferos terrestres de África y Australia [22], por lo tanto el papel del aislamiento geográfico en la evolución de T. cruzi no es sostenible.

El murciélago se alimenta de insectos o de pequeños vertebrados, solamente una de las familias, los vampiros se alimenta de la sangre de otros animales pues son hematófagos. El murciélago tiene una visión limitada, es capaz de desplazarse durante la noche gracias a su sistema de ecolocación, pues tiene un radar incorporado, basado en la movilidad del animal en el espacio, a partir de la percepción de ondas sonoras. Este procedimiento tan singular en el reino animal es posible porque el murciélago emite sonidos que se desplazan por el espacio en forma de ondas proporcionándole información sobre la situación de sus presas. La evidencia molecular reciente indica, que el T. cruzi evoluciono de tripanosomas de murciélagos lo cual se ha denominado como la hipótesis semilla-murciélago [22], basada en el hecho de que el pariente más cercano caracterizado genéticamente al T cruzi es el T. marinkellei de los murciélagos Suramericanos [21, 23, 24, 25]. Ambos se separaron hace 6,5-8,5 millones de años [26, 27] y pueden considerarse como subespecies, es decir T. c. cruzi y T. c. marinkellei [28]. Los descritos recientemente T. erneyi y T. livingstonei encontrados en murciélagos de Mozambique [29, 30], y T. dionisii encontrados en murciélagos del Viejo y Nuevo mundos [21, 23, 25, 31] son también parientes cercanos de T. cruzi. Más aun T cruzi se ha detectado en murciélagos Suramericanos [23, 32, 33] con un solo genotipo especifico el TcBat [34], relacionado estrechamente al T cruzi TcI, asociado con zarigüeya y Triatomineos del genero Rhodnius en ecotopes arbóreos [22], lo cual nos hace suponer que el ancestro común de los miembros del grupo de T cruzi era un tripanosoma de murciélagos que colonizaron Suramérica vía Norteamérica hace 7-10 millones de años [35]. Posteriormente varias líneas de tripanosomas de murciélagos se cambiaron a mamíferos terrestres viviendo en los mismos ecotopos facilitados por vectores invertebrados alimentándose en murciélagos y mamíferos terrestres [21]. Uno de esos cambios dio lugar al T. cruzi en el plioceno [36]. La diversificación de T. cruzi en los corrientes lineajes DTU TcI-TcVI y TcBat comenzó hace 1-3 millones de años [36].
Existe evidencia de que tan pronto como los humanos poblaron a Sur América se infectaron con T. cruzi. La primera demostración de un humano infectado con T cruzi se realizó en una momia de 9.000 años de antigüedad en la localidad de Chinchorro mediante amplificación por PCR de las secuencias del DNA del kinetoplasto del parasito [37]. Los Chinchorros fueron los primeros asentamientos humanos identificados a lo largo de la región costera del desierto de Atacama en la parte sur del Perú y el norte de Chile en Sur América. Humanos infectados con T cruzi también se encontraron en culturas posteriores a los Chinchorros viviendo en las mismas áreas geográficas hasta el tiempo de la conquista por los españoles en el siglo XVI [37]. En estas poblaciones las prevalencia para la infección por T cruzi fue de 41%, sin diferencias significativas entre las distintas culturas, indicando que en la era precolombina la ECh estaba diseminada en las sociedades civilizadas [37]. Las infecciones por T. cruzi también se detectaron en otras excavaciones arqueológicas en América [38], encontrándose DNA de T. cruzi en un cuerpo humano 7.000 años de antigüedad desenterrados en el Valle Peruaçu en el Estado de Minas Gerais en Brasil [39, 40]. Otra infección pre-histórica con T. cruzi se reportó en una momia encontrada hace 1.150 años en el desierto de Chihuahuan cerca al Rio Grande en Texas [38]. Además de haber detectado T cruzi en los restos humanos varias momias también mostraron signos clínicos de la ECh [37, 38, 39, 41]. Numerosas evidencias de la Tripanosomiasis Americana en tiempos precolombinos se encontraron en las cerámicas peruanas de los siglos XIII a XVI que muestran posibles representaciones de la ECh, incluyendo una cabeza con edema unilateral de la órbita reminiscencia del signo de Romaña [42].
Basados en datos paleo-parasitológicos existe la hipótesis de que la ECh se originó en la región de Los Andes [43]. Se cree que la población de los Chinchorros fueron los primeros en dejar una vida nómada y construir asentamientos permanentes para comenzar el arado de la tierra, las siembras y el cuidado del ganado vacuno [37, 41, 42]. Una vez asentados, esta población prehistórica invadió el ciclo selvático de T. cruzi y gradualmente se estableció el ciclo domestico de transmisión de la ECh [37, 42, 43] facilitado por la habilidad de algunas especies de Triatomineos, en particular el T. infestans de adaptarse a la vegetación más abierta y desarrollar una preferencia por el hábitat humano en el tiempo [44]. Es de hacer notar que los asentamientos rurales comprenden diversos grados de deforestación la cual está unida al aumento de la prevalencia de la ECh [44]. Esta conclusión se apoya en el hecho que la Tripanosomiasis Americana está ausente en los indígenas de la región Amazónica, que usan patrones socio-ambientales diferentes para ocupar la tierra, incluyendo viviendas comunales abiertas, no favorables para la colonización de los vectores de la ECh, están en continua movilidad, y hay ausencia de animales domésticos, todo lo cual impide la transmisión por los vectores de la ECh [45].
Del siglo XVI en adelante, médicos y viajeros describieron pacientes con síntomas reminiscentes de la tripanosomiasis americana. Un primer reporte por el medico portugués Miguel Díaz Pimenta (1661-1715) [46], en un libro publicado en 1707 relata posible signos intestinales de la ECh describiendo una condición llamada “bicho” causante de que los humores sean retenidos, causando anorexia, sin embargo un análisis del texto sugiere que estaba describiendo más bien hemorroides en vez del megacolon chagasico [47]. Una descripción más clara del signo megavisceral de la ECh la realizó el medico Portugués Luis Gomes Ferreira (1686-1764) quien describió en 1735 que la “corrupción del bicho es un aumento y distensión del recto” [48, 49]. Otros records describen una condición como “mal de engasgo” que probablemente se refiere a disfagia con dificultad para tragar [50, 51, 52]. El medico Danés Teodoro J. H. Langgaard (1813-1884), quien emigró a Brasil en 1842 describió la siguiente condición: “Usualmente el bolo alimenticio solo pasa por encima de la parte superior del cardias por encima del estómago. Algunos pacientes son capaces de forzar el descenso de los alimentos al estómago tomando pequeñas cantidades de agua después de cada bocado de comida. Como resultado de la nutrición defectuosa los pacientes pierden peso llegando a la emaciación” [48, 52]. Numerosas referencias históricas a la ECh se encuentran en un artículo de Guerra [53], todo lo cual indica que la ECh estaba presente en Latinoamérica desde los inicios del Siglo XVI, afectando tanto a los habitantes indígenas como a los conquistadores.
También existen numerosos reportes de insectos Triatomineos en Suramérica antes de que se hubiera descubierto su papel como vectores de T cruzi. [42, 48]. La más famosa mención del “Insecto del Beso” viene de Charles Darwin (1809-1882). El 25 de marzo de 1835 anoto en el diario de su viaje en El Beagle: “En la noche experimente un ataque, pues no merece un nombre menor, de la Benchuca, (una especie de Reduvideo), un insecto negro grande de las Pampas. Es muy desagradable sentir insectos suaves sin alas alrededor de una pulgada de largo, caminando sobre nuestro cuerpo. Antes de chupar sangre son delgados pero después se trasforman en redondos repletos de sangre y en ese estado pueden ser fácilmente destruidos. Ellos también se encuentran en la parte norte de Chile y Perú. Uno que capture en Iquique estaba muy vacío. Cuando lo coloque sobre la mesa rodeado de gente y se le presentaba el dedo de una persona se abalanzaba sobre él y si se le permitía, el insecto empezaba a chupar sangre. Ningún dolor era causado por la herida del insecto. Era muy curioso observar el cuerpo en el acto de chupar sangre, pues cambiaba en menos de 10 minutos de ser plano como una oblea a una forma globular. Después del festín por el cual la Benchuca estaba en deuda con uno de los oficiales, se mantuvo gordo durante 4 meses, pero después de la siguiente noche, el insecto estaba listo para otra chupada de sangre” [54]. Basados en este encuentro con el Insecto del beso y los prolongados síntomas gástricos y nerviosos de Charles Darwin, se ha pensado que Darwin estaba sufriendo de ECh tarde en su vida. Sin embargo algunos autores no piensan así, y opinan que la ECh no es un diagnostico probable para la enfermedad crónica de Darwin pues los síntomas desaparecieron al envejecer cuando no presento ninguno de los síntomas típicos de ECh y alguno de los síntomas ya los tenía antes del viaje en el Beagle [48]. A pesar de todos estos reportes el papel crítico de los insectos Triatomineos en la transmisión de la ECh permaneció sin descubrirse hasta 1909.
En la campaña antimalárica para permitir la construcción de una vía férrea en el Norte del Estado de Minas Gerais en Brasil, un Ingeniero de la compañía constructora alertó al higienista brasilero Carlos Chagas (1879-1934) (Figura 1) sobre la existencia de insectos grandes, chupadores de sangre, que vivían en grandes números en las casas de los moradores locales y picaban a la gente dormida, preferiblemente en la cara [55]. A fin de comprobar si estos insectos eran portadores de potenciales patógenos, Chagas los disecó encontrando numerosos tripanosomas en su intestino posterior a los cuales llamó Tripanosoma cruzi en honor a su mentor y profesor, el médico y bacteriólogo brasilero Oswaldo Cruz (1872-1917), (Fig. 9) [56].

Oswaldo Cruz, médico, bacteriólogo y epidemiólogo fue el mentor de Carlos Chagas quien descubrió la tripanosomiasis americana. Algunos de los insectos con tripanosomas fueron enviados a O. Cruz en Rio de Janeiro quien les permitió morder monos marmosete. A los 20-30 días, los monos mostraron infección con numerosos tripanosomas en sangre periférica. Posteriormente, Chagas demostró que el parasito infectaba a numerosos animales de laboratorio [55]. Chagas estaba seguro de que había encontrado un organismo patógeno de una enfermedad infecciosa humana pero no sabía qué tipo de enfermedad. El descubrimiento apareció en 1909 cuando fue llamado a examinar una niña de 2 años de edad llamada Berenice que tenía fiebre y aumento del tamaño del bazo y del hígado [55]. En el primer examen no encontró parásitos pero 4 días después, el 14 de abril de 1909 vio numerosos tripanosomas sanguíneos de morfología similar a los vistos en los monos [55]. Chagas había descubierto una nueva enfermedad humana que pronto llevaría su nombre. Luego dio una descripción clínica detallada de la fase aguda de la ECh y la unió con algunos síntomas crónicos, lo cual fue admirable, considerando que la fase crónica de la Tripanosomiasis Americana usualmente aparece décadas después de la infestación con T. cruzi [57]. Su primer paciente, Berenice nunca desarrolló la enfermedad crónica y murió a los 73 años de causas no relacionadas al Chagas. Es de hacer notar que si estuvo infectada con T. cruzi toda su vida lo cual fue confirmado por el aislamiento de los parásitos cuando tenía 55 y 71 años de vida [58]. Posteriormente Chagas reporto que había encontrado T. cruzi en un armadillo demostrando así el primer reservorio selvático de la enfermedad [59]. Gradualmente se encontraron más animales reservorios selváticos de la ECh suministrando la evidencia de la existencia de un ciclo enzootico de T. cruzi. Sin duda, el descubrimiento de la Tripanosomiasis Americana está totalmente unido a Carlos Chagas, habiendo contribuido su mentor O. Cruz y el Instituto que él y el gobierno brasileño fundaron en 1900 para luchar contra las enfermedades endémicas, todos jugaron un papel importante en el conocimiento de la ECh [60]. La identificación y caracterización del T. cruzi fue el resultado de la colaboración con el zoólogo y parasitólogo Stanislaus Prowasek (1875-1915), quien fue invitado por O. Cruz a pasar 6 meses en el Instituto Federal de Seroterapia [61]. El ciclo intracelular de T. cruzi, caracterizado por la forma amastigote, fue descrita por el patólogo brasileño Gaspar de Oliveira Vianna (1885-1914) en el corazón y las células musculares esqueléticas [62]. El modo de transmisión de T. cruzi fue establecido por el parasitólogo Francés Alexandre Joseph Emile Brumpt (1877-1951) quien suministró evidencia clara que la infección resultaba no por inoculación del insecto, sino por contaminación de la herida producida por la mordida del parasito con las heces fecales dejadas en la piel por el insecto Reduvideo [63]. El descubrimiento de una nueva enfermedad por C. Chagas le trajo un reconocimiento en todo el mundo, pero también animosidad y envidia en su propio país [64], lo cual le costó no haber recibido el premio Nobel al cual fue nominado dos veces en 1913 y 1921 y también detuvo el interés por la enfermedad por casi 20 años [60]. La investigación en la ECh se reanudo en la década de 1930, cuando el médico y epidemiólogo argentino Salvador Mazza (1886-1946) describió más de 1.000 casos de la ECh en la provincia Argentina del Chaco [65] y también fue el primero en sugerir la posibilidad de transmisión de la ECh por transfusión sanguínea [60]. La introducción de pruebas de serodiagnóstico para la ECh en 1940 demostró que la infección por T. cruzi estaba diseminada en toda Latinoamérica [56, 67].
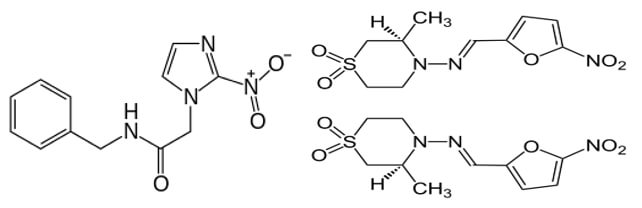
La búsqueda de compuestos para el tratamiento de la ECh comenzó pronto después del descubrimiento de la infección por el parasito pero sin resultados efectivos [68]. Pasaron 50 años antes del descubrimiento de dos compuestos o drogas para la quimioterapia de la ECh, en 1966 Hoffman-La Roche introdujo el Benznidazole para el tratamiento de la ECh y Bayer en 1970 comercializo el antichagasico Nifurtimox (Fig 10) [68].
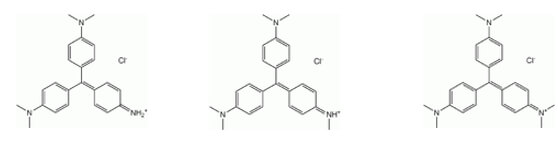
El violeta de metilo, comúnmente denominado cristal violeta o violeta de genciana, es el nombre dado a un grupo de compuestos químicos empleados como indicadores de pH y colorantes. Los violetas de metilo son mezclas de: N-tetra, N-penta y N-hexametil p-rosanilinas. Por la mezcla de diferentes versiones, el fabricante puede crear diferentes tonos de violeta en el colorante final. Cuanto más metilado esté el colorante, su color será de un violeta más oscuro: 1-Tetrametilo (cuatro metilos) es conocido como Violeta de metilo 2B, y encuentra usos específicos en química y medicina.2-Pentametilo (cinco metilos) es conocido como Violeta de metilo 6B, y es más oscuro como colorante que 2B. 3-Hexametilo (seis metilos) es conocido como Violeta de metilo 10B, o específicamente violeta cristal. Es mucho más oscura que la 2B, y aún más oscura que la 6Bk.
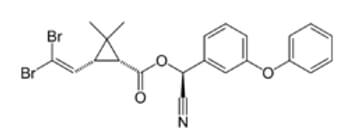
La producción de Nifurtimox fue suspendida en 1997 debido a la falta de demanda, pero reasumida en el año 2000 pues el compuesto formó parte de una combinación terapéutica para el tratamiento de la enfermedad del sueño en África [68, 69]. Al comienzo ambas drogas se usaron para el tratamiento de los casos agudos de ECh pues eran considerados menos efectivos para la fase crónica [68]. En 1953 se descubrió que el colorante cristal violeta (Fig 11), mataba al T. cruzi en las bolsas de sangre usadas para transfusiones sanguíneas [70]. Desde entonces el colorante ha sido ampliamente usado en los bancos de sangre en las áreas endémicas para eliminar los parásitos. El control del vector comenzó en 1940, cuando se desarrollaron los primeros insecticidas organoclorados. El DDT es un insecticida organoclorado sintético de amplio espectro, acción prolongada y estable, aplicado en el control de plagas para todo tipo de cultivos desde la década del cuarenta. Su potencial ecotóxico reside en que mata a los insectos por contacto, afectando su sistema nervioso. El DDT rápidamente se encontró sin efecto sobre la mayoría de los insectos Triatomineos sin embargo otros dos compuestos el Lindane y el Dieldrin fueron altamente efectivos contra los vectores cuando se aplicaba en las paredes de las casas de habitación (Fig. 10), [71, 72]. La introducción de insecticidas sintéticos como el deltamethrin y el cyfluthrin (Fig 12) al comienzo de la década de 1980 ha sido un avance importante en el control de los Triatomineos domésticos pues son mejores en términos de costo-efectividad y no dejan olores y marcas indeseables en las paredes de las viviendas [71, 72].
Actualmente se estima que en Latinoamérica existen de 7-8 millones de personas infectadas con T. cruzi y que más de 25 millones están en riesgo de contraer la ECh [1, 73], solamente en el año 2008 se reportaron más de 10.000 muertes por ECh [73]. Desde la década de 1990 las iniciativas multinacionales han conducido a una reducción significativa en el número de casos agudos de ECh, así como también en la presencia de Triatomineos domésticos en muchas regiones endémicas en Latinoamérica [1]. En Centroamérica el rociamiento con insecticidas residuales ha eliminado el R. prolixus [74]. A pesar de estos logros en el control del parásito y del vector han aparecido nuevos desafíos, incluyendo nuevos brotes de ECh en la cuenca amazónica, una región que se creyó previamente libre de la enfermedad, debido a transmisión oral por alimentos contaminados [74, 75, 76], y la transmisión activa de ECh en la región del Chaco Boliviano a pesar de los programas de control de vectores en progreso desde el año 2000 [77]. Otro problema es la aparición de vectores Triatomineos resistentes a los insecticidas en el Gran Chaco una región localizada al oeste del rio Paraguay y al este de los Andes [78]. A pesar de los numerosos esfuerzos en las décadas pasadas no se han desarrollado drogas para el tratamiento de la ECh crónica, y de acuerdo a las nuevas recomendaciones hechas en 2005 y 2007 el tratamiento con Nifurtimox y Benznidazole está indicado para pacientes con infección aguda así como también para pacientes menores de 18 años de edad con infección crónica, así como también en pacientes inmunosuprimidos [79, 80]. Los costos para el tratamiento y prevención de la ECh son otro desafío y son una carga muy alta para los sistemas de salud en los países afectados. En Colombia solamente los costos para la atención médica de los pacientes con ECh son de US $ 267 millones y para el rociamiento con insecticidas para el control, de vectores de US $ 5 millones, [81]. (Fig 14). La ECh se está transformando en un problema global debido a las migraciones de personas infectadas con T. cruzi desde los países endémicos a Norteamérica, Europa y la región del Pacifico Oeste. El número total estimado de pacientes con ECh fuera de Latinoamérica es más de 400.000, siendo USA el país más afectado con 3-4 partes de todos los casos [82, 83]. En Europa solamente el número de pacientes con miocardiopatía crónica chagasica se estima en 54.000 casos [83].
Encontramos que varias proteínas del suero fetal de ternera (SFT) estimulan la división y la incorporación de 3HTimidina en T. cruzi mediante su interacción con la membrana celular de los tripanosomas. En nuestro primer medio de cultivo [84] , [85] el T. cruzi presentó un ciclo con 100% de epimastigotes en la fase exponencial de crecimiento al día 12 y 88% de tripomastigotes en la fase estacionaria al día 16 de cultivo. Cinco proteínas del SFT estimuladoras de la división del T. cruzi mostraron los siguientes pesos moleculares: Proteína 1: 100.000 Da; proteína 2: 76.000 Da; proteínas 3, 4 y 5: 68.000 Da [86]. Las proteínas cambiaron su estructura durante la fase logarítmica de crecimiento del T. cruzi, base de la autoinmunidad en la ECh [87]. El complejo mitocondria-kinetoplasto en los epimastigotes mostro una nueva estructura formada por un patrón de canales con una estructura como un cristal en el citoplasma y también otra nueva estructura al final del flagelo para fijar el T cruzi a la superficie de los frascos de cultivo plásticos, y a las membranas celulares de las células de los mamíferos [88]. La inmunoglobulina IgG de cabra con actividad específica anti-proteínas del SFT que estimulan la división de T cruzi marcada con fluorocromos se localizó en el citoplasma de T cruzi. Usando las proteínas que estimulan la división del parasito en el SFT marcadas con 125I en el medio de cultivo, estas también se encontraron en gránulos citoplasmicos en el T cruzi mediante autoradiografía. Igualmente las proteínas del SFT que estimulan la división marcadas con oro coloidal, se encontraron en las membranas, citostoma, libres en el citoplasma y en gránulos citoplasmicos, probablemente lisosomas algunos abiertos al núcleo del parasito en división en contacto con la membrana perinuclear enviando péptidos que inducen la división del DNA y la división celular en los tripanosomas [89]. La fracción insoluble de las membranas de T. cruzi, L. donovani y L. mexicana inducen la lisis de glóbulos rojos de mamíferos y células Vero. El agente lítico es resistente a la pronasa, a la tripsina y al aumento de la temperatura, su acción tiene un pH óptimo de 6.5 y está presente en la fase lipídica de los extractos de T. cruzi; su acción lítica es inhibida por la albumina [90] , [91]. El T. cruzi tiene un patrón característico de aminoácidos libres diferente al de las células de mamíferos, producidos por su actividad proteolítica, formado en un 75% por acido glutámico, prolina, glicina y alanina, lo cual debe tenerse presente en los procesos de purificación de antígenos en los extractos de parásitos para la producción de vacunas. La actividad proteolítica del parasito tiene un óptimo entre pH 4.5 a 8.0 y es inhibida por inhibidores de enzimas proteolíticas tales como ZPCK, TPCK, PMSF, and TLCK [92]. Estos resultados demuestran que la inyección de parásitos o sus fracciones, debe considerar la destrucción de las proteínas antigénicas en un periodo de tiempo muy corto, inhibiendo la respuesta inmune protectora contra los parásitos virulentos. Con los valores obtenidos de la concentración de aminoácidos libres en T cruzi producto de su actividad proteolítica a las 24 horas en los extractos totales del parasito preparamos un nuevo medio de cultivo enriquecido (medio O’Daly) que permitió el crecimiento de epimastigotes de T cruzi entre 26° - 37° C. donde analizamos los requerimientos nutritivos de T cruzi a diferentes temperaturas con SFT o en péptidos purificados del SFT. Un péptido compuesto por un ácido glutámico, dos alaninas y una lisina substituyo al SFT en el crecimiento de los tripanosomas en el medio O’Daly [93, 94]. Ratones homocigotos C3H/He y C57Bl/6 infectados con 500 tripanosomas de la cepa Y de T. cruzi mostraron parasitemia, aumento del bazo y de los ganglios linfáticos, parásitos intracelulares en el corazón y aumento en la concentración de la IgG y la IgM en el suero. En el punto mayor de la parasitemia los 17 días post-infección, se encontró una disminución marcada de la respuesta de los linfocitos a mitogenos de linfocitos T y B a los antígenos del parasito y a las células formadoras de placas a glóbulos rojos de carnero [95]. Tripomastigotes sanguíneos de la cepa Y de T. cruzi inhibieron la respuesta de mitógenos T y B en células nucleadas de bazo de ratones C3H/He, C57Bl/6 y BALB/cJ, mientras que epimastigotes de cultivo de la misma cepa de T cruzi cultivados en medio O’Daly que permite el crecimiento de los parásitos a 26°, 30°, 34° y 37°C indujeron un efecto estimulador muy fuerte, aun mayor que el efecto de los mitogenos solos. Tanto el efecto estimulador como el efecto inhibidor mostraron una relación dosis-respuesta. El efecto estimulador dependió de la temperatura, los índices de estimulación fueron mayores al aumentar la temperatura de los cultivos [96]. Los sobrenadantes de células de bazo de ratones C3H/He y C57Bl/6 infectados con T. cruzi mostraron proteínas hidroinsolubles de peso molecular entre 14.000-15.000 daltons, pI 6.6, capaces de inducir un efecto inmunosupresor de la respuesta blastogenica a mitogenos in vitro. El efecto inhibidor atravesó de la barrera haplotipica H2K-H2b, su actividad fue dependiente de la dosis, su producción se relacionó con el periodo de infección mostrando un máximo a los 17 días post-infección por los esplenocitos infectados. Es un producto del huésped infectado y actúa a través de su interacción con macrófagos normales transformándolos en inmunosupresores. Una proteína inmunosupresora con igual pI de 6.6, ausente del suero normal se detectó en el suero de los animales infectados [97]. A fin de detectar antígenos de tripanosomas en la superficie de linfocitos de ratones infectados se usaron antisueros anti-epimastigotes y anti-tripomastigotes de T. cruzi. Solo el suero anti-tripomastigotes reconoció antígenos expresados transitoriamente en las membranas de esplenocitos de animales infectados. El número o la conformación estructural de los receptores de Concanavalin A fueron también afectados y se vio una correlación clara entre estos dos tipos de cambios en la membrana y la inmunosupresión a mitogenos y a glóbulos rojos de carnero (GRC) encontrada en los ratones infectados. Los animales re-infectados no mostraron evidencias de proliferación de tripanosomas en la sangre o en los tejidos, ni tampoco antígenos de tripomastigotes en los esplenocitos, pero presentaron una inmunosupresión transitoria menos intensa, medida por la respuesta a mitogenos y GRC lo cual sugiere que el sistema inmune activado una primera vez puede eliminar el nuevo inoculo parasitario antes de que el huésped este inmunosuprimido y también que la liberación de antígenos fuertes inmunosupresores por los tripomastigotes induce el nuevo estado menos intenso y transitorio de supresión [98]. Epimastigotes de T. cruzi cambian el patrón de proteínas de superficie cuando la temperatura de crecimiento en el cultivo aumenta de 30° a 34° C. El reto de los ratones con tripomastigotes sanguíneos produjo parasitemias altas cuando los animales fueron inmunizados con proteínas de superficie de epimastigotes cultivados a 30° C y con sedimentos de epimastigotes extraídos con Nonidet P-40 cultivados a 34° C. Por el contrario se observaron parasitemias bajas después de la inmunización con proteínas de superficie de epimastigotes cultivados a 34° C o de sedimentos de epimastigotes extraídos con Nonidet P-40 y cultivados a 30° C. La parasitemia menor con el mayor tiempo de sobrevida y ausencia de inmunosupresión se observó después de la inmunización de los ratones con el producto extraído con el detergente no-iónico NP-40, de epimastigotes cultivados a 30° C y tratados con Tosyl-L-lysine-chloromethyl ketone [99].
Productos secretados por L. (L) amazonensis (La); L. (L) venezuelensis H16 y H17 (Lv16, Lv17); L. (V) brasiliensis H27 y H2 (Lb27,Lb2); L. (L) chagasi (Lch); L. (L) pifanoi (Lp) y L. garnhami (Lg) fueron caracterizados en un medio de cultivo químicamente definido [93] (Medio O’Daly) donde se encontraron bandas de proteínas y glicoproteínas reveladas en geles coloreados con los siguientes números, Coomassie (13.8±1.5), Plata (10.2±3.3), PAS-Schiff (7.4±2.5) y ConA(5.33±1.9). La inmunización con productos secretados de Lg, Lv16, Lp y con amastigotes de cultivo tratados con TLCK y extraídos con NP-40 indujeron protección completa contra la infección con amastigotes virulentos desde la semana 14 a la semana 24 de seguimiento. ANOVA unidireccional entre Lg, Lv16, Lp, vacuna polivalente (VP) y control no inmunizado (CNI) mostraron p<0.001. Lch, Lv17, Lb and La, también mostraron regresión de las lesiones con solo un 5%-10% de aumento en la almohadilla plantar comparadas con el CNI. La reacción de hipersensibilidad retardada (DTH) fue mayor con los productos secretados de Lg, Lv16, Lp y la VP, lo cual se correlaciona con la ausencia de lesiones después de la infeccion. Lch, La, y Lb también mostraron valores de DTH positivos pero menores que la VP. Los immunoblottings con sueros de ratones inmunizados con Lg, Lv16, y Lp mostraron bandas densas de 83 kDa y de 50 a 55 kDa. Después de la infeccion de los ratones inmunizados ocurre un suiche en las células B, los anticuerpos IgG ahora reconocen productos secretados de bajo peso molecular entre 27-33 kDa y 23-26 kDa coincidentes con la regresión completa de las lesiones lo cual no ocurrió en ratones infectados con Lch, Lv17, Lv16, and Lp donde las lesiones persistieron [100].
Proteínas de superficie, secretadas y totales de T. cruzi y T. rangeli crecidos en medios sintéticos, químicamente definidos (medio O’Daly) [93] se usaron como antígenos para el diagnóstico de la ECh por ELISA e Immunoblottings. El suero de pacientes con miocardiopatías Chagasicas y no Chagasicas, de donantes de sangre, de controles sanos, y de pacientes con otras enfermedades tropicales mostraron extensas reacciones cruzadas entre los antígenos de T. cruzi y T. rangeli, los cuales mostraron patrones muy similares en los immunoblottings. El patrón antigénico con sueros chagasicos es muy específico y diferente a los patrones con otras enfermedades tropicales. Las proteínas secretadas por T. cruzi así como también las infecciones por T. rangeli juegan un papel importante en la patogenia de la ECh [101].
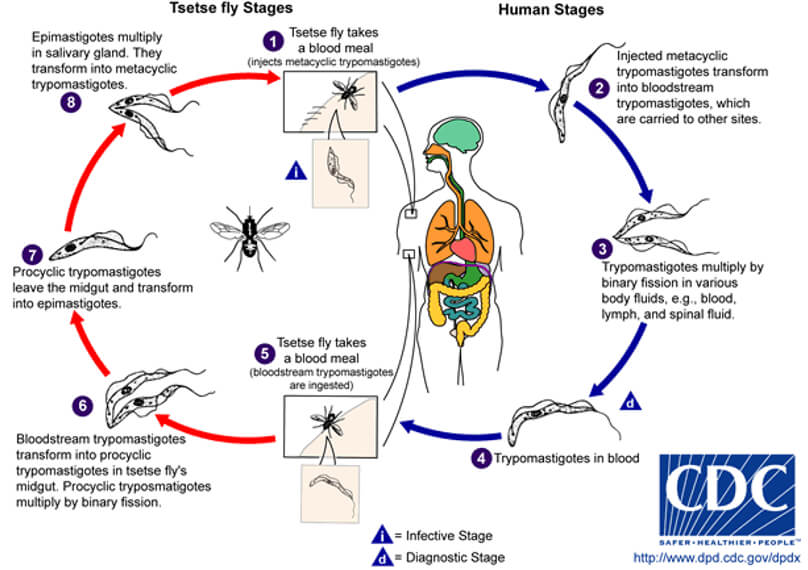
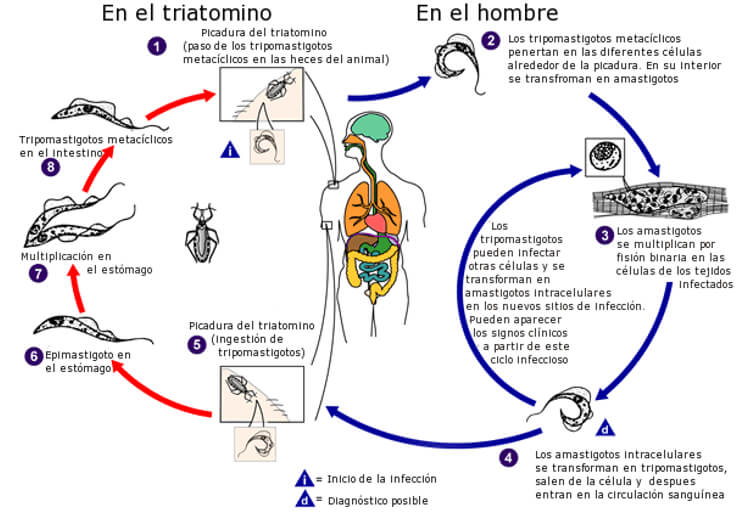
El ciclo de vida del T. cruzi nos ilustra sobre la versatilidad del parasito en colonizar vertebrados e invertebrados (Fig 13) en un área geográfica extensa en Norte, Centro y Sur América (Fig 14). La patogénesis de la ECh parece estar relacionada a una mutación inducida por el parasito en el genoma del vertebrado infectado. Se ha detectado transferencia horizontal de los minicírculos del DNA del kinetoplasto (kDNA) al genoma del huésped mamífero [102] , [103] , [104] , [105] , [106]. Más aun, una secuencia truncada de kDNA se encontró en el genoma de un baboon (Papyo hamadryas) en los flancos del DNA del huésped [107]. Transferencias (Blots) con el método de Souther del DNA genómico de corazón, musculo esquelético e intestino de un conejo con ECh crónica hibridizaron con una sonda de kDNA de T.cruzi. Se ha sugerido que la infeccion persistente por T cruzi puede ser una fuente acumulativa de mutaciones en el kDNA del parasito [107]. En la actualidad los tratamientos no son satisfactorios. Existen 40 especies de Triatomineos que pueden ser portadores de T. cruzi y transmisores potenciales de la infeccion [19], las cuales se adaptaron al área peri-domiciliar en los ecosistemas secos de América Central y América del Sur y son los principales transmisores de la infeccion (Fig 13) responsables de 10-12 millones de casos humanos de ECh [4, 108]. Luego siguen en importancia epidemiológica las especies de Rhodnius que habitan en climas húmedos tropicales y las especies de Panstrongylus que son ubicuas [4, 108]. Después de una comida con sangre los Triatomineos se hinchan y los tripomastigotes metacíclicos infecciosos pasan a las heces del vector. Los tripomastigotes entran al cuerpo cuando el individuo se rasca la piel en la herida producida por la parte bucal del insecto o también a través de una mucosa permisiva o la conjuntiva ocular (Fig. 15). Al entrar en el cuerpo (Fig. 13), los tripomastigotes invaden a los histiocitos, sobreviven a las vacuolas parasitoforas y evaden el ambiente hostil para permanecer libremente en el citoplasma celular de la célula huésped. En la puerta de entrada, tanto en la piel como en la conjuntiva ocular, clínicamente se observa un proceso indurado inflamatorio crónico, típico de una reacción de sensibilidad retardada (DTH). Los flagelados intracelulares se redondean y se transforman en amastigotes que sufren muchos ciclos de multiplicación por fisión binaria, los cuales posteriormente se diferenciarán en tripomastigotes móviles (Fig. 13) que al romperse la célula llegaran al torrente sanguíneo para infectar otras células en el cuerpo del mamífero. Las primeras investigaciones en la ECh mostraron una relación directa entre la densidad de los receptores en la membrana del huésped infectado y la carga parasitaria en los tejidos [109]. Cada célula en el cuerpo humano excepto las neuronas puede ser colonizada por el T. cruzi in vivo. La infeccion por T. cruzi persiste en el cuerpo humano toda la vida, comienza por la invasión tisular de las células reticulo-endoteliales locales, donde posteriormente el parasito se multiplica, penetra el endotelio vascular de los pequeños vasos intraparenquimatosos como los capilares y precapilares hasta alcanzar la circulación sistémica e invadir varios tejidos de acuerdo a su tropismo tisular, fundamentalmente musculo esquelético, y cardiaco, sistema digestivo, órganos linfohematopoyeticos, y sistema nervioso (Fig. 16 y 17). La disfunción endotelial dispara la cascada de eventos subcelulares que conducen a la inflamación del miocardio, pericardio y endocardio con la aparición progresiva de cicatrices en la matriz extracelular. La acción más evidente del T. cruzi es el bloqueo de las células presentadoras de antígenos a través de la proteína Tcsc y su inmunoglobulina, agonistas de los receptores β-adrenérgicos. La inoculación de T. cruzi en huevos embrionados de gallinas, genera pollos libres de parásitos que retienen secuencias de minicírculos de kDNA en el cuerpo, en ausencia del DNA nuclear del T. cruzi. El kDNA se integra en el genoma de las células somáticas y germinales, desde donde es transmitido verticalmente a la progenie que al ser cruzados entre sí, progenie positiva para kDNA. Las mutaciones en el kDNA se detectan principalmente en regiones codificadas o codones, en varios cromosomas. Es de hacer notar que los pollos con mutaciones en kDNA, desarrollan cardiomegalia con una miocarditis inflamatoria similar a la que se ve en la ECh en humanos, donde miofibrillas libres de parásitos son destruidas por las células efectoras del sistema inmunológico originando insuficiencia cardiaca. La progresión de un estado fisiológico a una condición fisiopatológica está asociada con una mutación multigenica del kDNA, y es dependiente de una proliferación clonal de células T en el modelo de los pollos, mostrando ruptura de múltiples genes, citotoxicidad acelerada anti-antígenos del animal y enfermedad de Chagas cardiaca autoinmune [104, 107].
La historia de la ECh nos enseña que los cambios ambientales de origen humano son la causa primaria para la transmisión de la infección siendo la deforestación el factor más importante, al traer las poblaciones a un contacto más directo con los vectores transmisores de la enfermedad. Esto se basa en el hecho de que la transmisión de la ECh se indujo desde tiempos antiguos cuando los humanos comenzaron a limpiar la tierra para habitarla y practicar la agricultura. La minería, la industria de la madera y la urbanización unida a la deforestación, condujeron a la diseminación de la ECh en tiempos recientes. También hemos aprendido que los vectores Triatomineos tienen una habilidad increíble para adaptarse rápidamente a nuevos ambientes y a nuevos huéspedes creando ciclos de transmisión domestica entre animales y humanos cruciales para la distribución de la ECh en Latinoamérica. A través de las migraciones la ECh se ha transformado en un problema de salud global.